10 Class Science Chapter 2 – NCERT (अम्ल, क्षारक एवं लवण – Acids, Bases and Salts) Notes in hindi
Class 10 science Chapter 2 अम्ल , क्षारक एवं लवण notes in hindi. जिसमे हम H⁺ और OH⁻ आयनों की प्रस्तुति के संदर्भ में उनकी परिभाषा, सामान्य गुण, उदाहरण और उपयोग, PH स्केल की अवधारणा , PH स्केल का रोजमर्रा की जिंदगी में महत्व , सोडियम हाइड्रॉक्साइड, ब्लीचिंग पाउडर, बेकिंग सोडा, वाशिंग सोडा और प्लास्टर ऑफ पेरिस आदि के बारे में पड़ेंगे ।
अम्ल की परिभाषा :-
अम्ल को अंग्रेजी भाषा में ऐसिड कहते हैं , ऐसिड शब्द की उत्पत्ति लैटिन भाषा के शब्द ‘ एसिड्स ’ ( Acidus ) से हुई है , जिसका अर्थ खट्टा ( Sour ) होता है । अतः हम कह सकते हैं कि जो पदार्थ स्वाद में खट्टे होते हैं वे अम्ल होते हैं ।
अम्ल के गुण :-
अम्ल के भौतिक गुण :-
- स्वाद में खट्टा होते हैं ।
- नीले लिटमस को लाल कर देते हैं ।
- जलीय विलयन में H+ आयन देता ।
- जलीय विलयन में विधुतधारा प्रवाहित करना ।
अम्ल के रासायनिक गुण :-
- धातु के साथ अभिक्रिया कर H₂ निष्कासित करना ।
- धातु कार्बोनिट / हाइडोजन कार्बोनेट के साथ अभिक्रिया कर CO₂ निष्कासित करना ।
- कुछ धातु ऑक्साइड अम्ल में साथ अभिक्रिया कर लवण और जल बनाना ।
अम्ल के प्राकृतिक स्रोत :-
- नीबू ( साइट्रिक अम्ल )
- टमाटर ( ऐस्कार्बिक अम्ल )
- अंगुर ( टार्टरिक अम्ल )
- सिरका ( ऐसिटिक अम्ल )
- दूध ( लेक्टिक अम्ल )
- इमली ( टार्टरिक अम्ल )
- सेब ( मैलिक अम्ल )
अम्लों के प्रकार :-
- प्रबल अम्ल
- दुर्बल अम्ल
- सान्द्र अम्ल
- तनु अम्ल
प्रबल अम्ल :-
वे अम्ल , जो जलीय विलयन में पूर्णत : आयनित हो जाते है , प्रबल अम्ल कहलाते हैं । सल्फ्यूरिक अम्ल ( H₂SO₄ ) , हाइड्रोक्लोरिक अम्ल ( HCI ) नाइट्रिक अम्ल ( HNO₃ ) , हाइड्रोब्रोमिक अम्ल आदि प्रबल अम्लों के उदाहरण है ।
प्रबल अम्लों में प्रोटॉन अर्थात् हाइड्रोजन आयन ( H + ) त्याग करते की उच्च क्षमता होती है अर्थात् प्रबल अम्ल अपने संघटक तत्वों के आयनों में विखण्डित हो जाते हैं ।
दुर्बल अम्ल :-
अम्ल , जो जलीय विलयन में पूर्णत : आयनित न हो कर आंशिक रूप से आयनित होते हैं , दुर्बल अम्ल कहलाते हैं । एसिटिक अम्ल ( CH₃COQH ) , फॉर्मिक अम्ल ( HCOOH ) , हाइड्रोजन सल्फाइड ( H₂S ) आदि दुर्बल अम्लों के उदाहरण हैं ।
दुर्बल अम्ल अपने हाइड्रोजन आयनों ( H+ ) का पूर्णत : त्याग नहीं करते हैं । समान सांद्रता पर दुर्बल अम्लों का pH मान प्रबल अम्लों से अधिक होता है ।
सान्द्र अम्ल :-
जिसमें अम्ल अधिक मात्रा में होता है , जबकि जल अल्प मात्रा में होता है ।
तनु अम्ल :-
जिसमें अम्ल अल्प मात्रा में होता है , जबकि जल अधिक मात्रा में होता है ।
क्षारक :-
ऐसे पदार्थ जिनका स्वाद कड़वा होता है और जो स्पर्श करने पर साबुन जैसे लगते हैं । क्षारक कहलाते हैं ।
क्षारक के गुण :-
क्षार के भौतिक गुण :-
- स्वाद में कडवा होता है ।
- लाल लिटमस को नीला कर देता है ।
- जलीय विलयन में OH- आयन देता है ।
- जलीय विलयन में विधुतधारा प्रवाहित न करना ।
क्षार के रासायनिक गुण :-
- क्षार धातु के साथ अभिक्रिया कर H₂ मुक्त करता है ।
- क्षार अम्लीय ऑक्साइड के साथ अभिक्रिया कर लवण बनाता है ।
सूचक :-
सूचक किसी दिए गए विलयन में अम्लया क्षारक की उपस्थिति दर्शाते हैं । इनका रंग या गंध अम्लीय या क्षारक माध्यम में बदल जाता है ।
सूचक के प्रकार :-
वैसे तो संसूचक बहुत प्रकार के होते है । परन्तु इनके समान्य प्रकार इस प्रकार है :-
1. प्राकृतिक सूचक :-
वे सूचक जो प्राकृतिक स्रोतों के प्राप्त होते है प्राकृतिक संसूचक कहलाते है । जैसे :- लिटमस , लाल पत्तागोभी का रस , हल्दी , हायड्रेजिया के फूल का रस आदि ।
लिटमस :-
- अम्ल तथा क्षारक की पहचान के लिए सबसे सामान्य रूप से उपयोग में लाया जाने वाला प्राकृतिक सूचक लिटमस है ।
- लिटमस को लाईकेन ( शैवाल ) से प्राप्त किया जाता है ।
लिटमस पत्र :-
- लिटमस विलयन के रूप में तथा कागज़ की पट्टियों के रूप में उपलब्ध होता है , इन कागज की पट्टियों को लिटमस पत्र कहते हैं ।
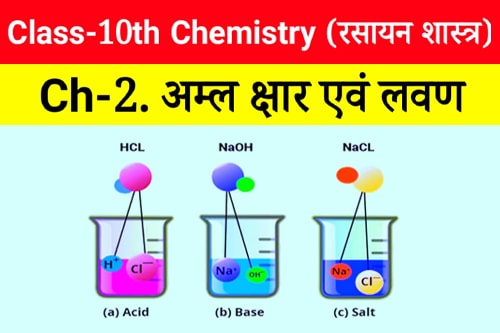
- लिटमस पत्र दो रंगों का होता है नीला एवं लाल , अम्ल नीले लिटमस पत्र को लाल कर देता है जबकि क्षार लाल लिटमस पत्र को नीला कर देता है ।
हल्दी :-
- हल्दी भी एक अन्य प्रकार का प्राकृतिक सूचक है ।
- यह पीला रंग का होता है ।
- कई बार आपने देखा होगा जब किसी सफ़ेद कपड़ों पर सब्जी का दाग लग जाता है और जब इसे साबुन ( क्षारीय प्रकृति ) से धोते है तो यह उस दाग के धब्बे को भूरा – लाल कर देता है ।
- अम्ल के साथ हल्दी के रंग में कोई परिवर्तन नहीं होता है ।
- क्षारक के साथ इसका रंग भूरा – लाल हो जाता है ।
2. संश्लेषित सूचक :-
- ये वे सूचक है जो प्राकृतिक नहीं होते अपितु ये रसायनिक पदार्थों द्वारा बनाए गए होते है ।
- जैसे :- मेथिल ऑरेंज एवं फिनोल्फ्थेलीन आदि ।
- इनका उपयोग अम्ल एवं क्षारक की जाँच के लिए होता है ।
3. गंधीय सूचक :-
कुछ ऐसे पदार्थ होते हैं जिनकी गंध अम्लीय या क्षारकीय माध्यम में बदल जाती है , ऐसे पदार्थों को गंधीय सूचक कहते हैं । जैसे :- प्याज एवं लौंग और तेल आदि ।
4. सार्वत्रिक सूचक :-
सार्वत्रिक सूचक विभिन्न रसायनों का बना हुआ वह मिश्रण है जो भिन्न भिन्न pH वाले पदार्थ के बारे में रंग परिवर्तन के द्वारा बता देते हैं कि वह क्षारक हैं या अम्ल ।
लवण :-
धातु , अम्लों से हाइड्रोजन परमाणुओं का हाइड्रोजन गैस के रूप में विस्थापन करती है और एक यौगिक बनाता है जिसे लवण कहते हैं ।
लवण के गुण :-
- लवण ठोस अवस्था में मिलते हैं ।
- सामान्यतः लवण उदासीन होते हैं ।
- लवणों के जलीय विलयन विद्युत के सुचालक होते हैं ।
पॉप टैस्ट :-
हाइड्रोजन गैस से निहित परखनली के पास जब एक जलती हुई मोमबत्ती लाई जाती है , तो पॉप की ध्वनि उत्पन्न होती है । इस टैस्ट को हाइड्रोजन की उपस्थिति दर्शाने के लिए प्रयोग करते हैं ।
अम्ल एवं क्षारक की धातु के साथ अभिक्रिया :-
अम्ल के साथ धातु की अभिक्रिया :-
- अम्ल + धातु → लवण + हाइड्रोजन
- 2HCl + Zn → ZnCl₂ + H₂
क्षारक के साथ धातु की अभिक्रिया :-
- क्षार + धातु → लवण + हाइड्रोजन
- 2NaOH + Zn → Na₂ZnO₂ + H₂
उदासीन :-
ऐसे पदार्थ जो लाल अथवा नीले लिटमस पत्र के रंग को परिवर्तित नहीं करते हैं , उदासीन कहलाते हैं ।
ऐसे पदार्थ न तो अम्लीय होते हैं और न ही क्षारकीय होते हैं ।
जैसे :- नमक , नौसादर , केल्शियम क्लोराइड , सोडियम कार्बोनेट , सोडियम बाइकार्बोनेट आदि ।
उदासीनीकरण अभिक्रिया :-
जब अम्ल द्वारा क्षारक का प्रेक्षित प्रभाव तथा क्षारक द्वारा अम्ल का प्रभाव समाप्त हो जाता है और परिणामस्वरूप लवण और जल प्राप्त होते हैं तो उदासीनीकरण अभिक्रिया होती है ।
उदहारण :-
- NaOH (aq) + HCI (aq) → NaCl (aq) + H₂O (l)
- प्रबल अम्ल + दुर्बल क्षारक → अम्लीय लवण + जल [ विलयप का pH 7 से कम ]
- दुर्बल अम्ल + प्रबल क्षारक → क्षारीय लवण + जल [ विलयन का pH 7 से अधिक ]
- प्रबल अम्ल + प्रबल क्षारक → उदासीन लवण + जल [ विलयन का pH = 7 ]
- दुर्बल अम्ल + दुर्बल क्षारक → उदासीन लवण + जल [ विलयन का pH 7 ]
अम्लों के साथ धात्विक ऑक्साइडों की अभिक्रिया :-
- धात्विक आक्साइड + अम्ल → लवण + जल
- CaO + 2HCl → CaCl₂ + H₂O
धात्विक आक्साइड की प्रवृति क्षारीय होती है । क्योंकि ये अम्ल के साथ क्रिया करके लवण और जल बनाते हैं ।
उदाहरण :- Cuo , Mgo
अम्लों व क्षारकों में समानताएं :-
- सभी अम्ल H⁺ आयन उत्पन्न करते हैं ।
- सभी क्षारक OH⁻ आयन उत्पन्न करते हैं ।
जलीय विलयन में अम्ल या क्षारक का क्या होता है ?
जल में अम्ल या क्षारक मिलाने पर आयन की सांद्रता ( H₃O⁺ या OH⁻ ) में प्रति इकाई आयतन में कमी हो जाती है । इस प्रक्रिया को तनुकरण कहते हैं एवं अम्ल या क्षारक तनुकृत होते हैं ।
क्षार तथा अम्ल की प्रबलता :-
किसी क्षार या अम्ल की प्रबलता उसके द्वारा उत्पन्न H+ आयन या OH- आयनों की संख्या पर निर्भर करती है ।
किसी अम्ल या क्षारक की प्रबलता हम एक सार्वभौमिक सूचक द्वारा ज्ञात कर सकते हैं ।
सार्वभौम सूचक :-
अनेक सूचकों का मिश्रण होता है ।
यह सूचक किसी विलयन में हाइड्रोजन आयन की विभिन्न सांद्रता को विभिन्न रंगों में प्रदर्शित करते हैं ।
pH स्केल :-
किसी विलयन में उपस्थित H⁺ आयन की सांद्रता ज्ञात करने के लिए एक स्केल विकसित किया गया जिसे pH स्केल कहते हैं ।
- pH में p है ‘ पुसांस ‘ ( Potenz ) जो एक जर्मन शब्द है , जिसका अर्थ होता है शक्ति । अगर :-
- PH = 7 → उदासीन विलयन
- PH < 7 → अम्लीय विलयन
- PH > 7 → क्षारीय विलयन
दैनिक जीवन में pH का महत्त्व :-
पौधे एवं पशु pH के प्रति संवेदनशील होते हैं । :-
हमारा शरीर 7.0 से 7.8 pH परास ( range ) के बीच कार्य करता है ।
मिट्टी का pH :-
अच्छी उपज के लिए पौधों को एक विशिष्ट pH परास की आवश्यकता होती है । यदि किसी स्थान की मिट्टी का pH कम या अधिक हो तो किसान उसमें आवश्यकतानुसार अम्लीय या क्षारीय पदार्थ मिलाते हैं ।
हमारे पाचन तंत्र का pH :-
हमारा उदर ( stomach ) हाइड्रोक्लोरिक अम्ल ( HCI ) उत्पन्न करता है जो भोजन के पाचन में सहायक होता है ।
अपच की स्थिति में उदर अधिक मात्रा में अम्ल उत्पन्न करता है जिसके कारण उदर में दर्द व जलन का अनुभव होता है ।
इस दर्द से मुक्त होने के लिए ऐन्टैसिड ( antacid ) जैसे क्षारकों का उपयोग किया जाता है जो अम्ल की अधिक मात्रा को उदासीन करता है । जैसे ( मिल्क ऑफ मैग्नीशिया )
pH परिवर्तन के कारण दंत क्षय :-
मुँह के pH का मान 5.5 से कम होने पर दाँतों का क्षय प्रारंभ हो जाता है ।
दाँतों का इनैमल ( दन्तवल्क ) कैल्सियम फॉस्फेट से बना होता है जो कि शरीर का सबसे कठोर पदार्थ होता है , यह जल में नहीं घुलता लेकिन मुँह की pH का मान 5.5 से कम होने पर संक्षारित हो जाता है ।
क्षारकीय दंत – मंजन का उपयोग करने से अम्ल की आधिक्य मात्रा को उदासीन किया जा सकता है ।
पशुओं एवं पौधों द्वारा उत्पन्न रसायनों से आत्मरक्षा :-
मधुमक्खी का डंक एक अम्ल छोड़ता है जिसके कारण दर्द एवं जलन का अनुभव होता है । डंक मारे गए अंग में बेकिंग सोडा के उपयोग से आराम मिलता है ।
नेटल ( Nettle ) के डंक वाले बाल मैथनोइक अम्ल छोड़ जाते हैं जिनके कारण जलन वाले दर्द का अनुभ व होता है । इसका इलाज डंक वाले स्थान पर डॉक पौधे की पत्ती रंगड़कर किया जाता है ।
अम्लीय वर्षा :-
वर्षा के जल की pH मान जब 5.6 से कम हो जाती है तो वह अम्लीय वर्षा कहलाती है ।
लवणों का pH :-
- प्रबल अम्ल एवं प्रबल क्षारक के लवण के pH का मान 7 होता है तथा ये उदासीन होते हैं ।
- जबकि प्रबल अम्ल एवं दुर्बल क्षारक के लवण के pH का मान 7 से कम होता है तथा ये अम्लीय होते हैं ।
- प्रबल क्षारक एवं दुर्बल अम्ल के लवण के pH का मान 7 से अधिक होता है तथा ये क्षारकीय होते हैं ।
साधारण नमक से रसायन :-
सोडियम क्लोराइड NaCl को साधारण नमक कहा जाता है जिसे हम भोजन में इस्तेमाल करते हैं ।
इसे समुद्री जल से बनाया जाता है ।
रॉक Salt एक भूरे रंग की क्रिस्टल के रूप में पाया जाने वाला पदार्थ है । इसे कोयले की तरह निष्कर्षण करके प्राप्त किया जाता है ।
साधारण नमक – रसायनों का कच्चा पदार्थ :-
इस प्रकार प्राप्त साधारण नमक हमारे दैनिक उपयोग के कई पदार्थों ; जैसे :- सोडियम हाइड्रॉक्साइड , बेकिंग सोडा , वाशिंग सोडा , विरंजक चूर्ण आदि के लिए एक महत्वपूर्ण कच्चा पदार्थ है ।
1. सोडियम हाइड्रॉक्साइड ( NaOH ) :-
सोडियम क्लोराइड के जलीय विलयन ( लवण जल ) से विद्युत प्रवाहित करने पर यह वियोजित होकर सोडियम हाइड्रॉक्साइड उत्पन्न करता है । इस प्रक्रिया को क्लोर – क्षार प्रक्रिया प्रक्रिया कहते हैं क्योंकि इससे निर्मित उत्पाद क्लोरीन ( क्लोर ) एवं सोडियम हाइड्रॉक्साइड ( क्षार ) होते हैं ।
- 2NaCl (aq) + 2H₂O(l) → 2NaOH (aq) + Cl₂(g) + H₂( g )
क्लोरीन गैस ऐनोड पर मुक्त होती है एवं हाइड्रोजन गैस कैथोड पर । कैथोड पर सोडियम हाइड्रॉक्साइड विलयन का निर्माण भी होता है । इस प्रक्रिया से उत्पन्न हुए तीनों उत्पाद उपयोगी हैं ।
2. विरंजक चूर्ण :-
शुष्क बुझे हुए चूने [Ca(OH)₂] पर क्लोरीन की क्रिया से विरंजक चूर्ण का निर्माण होता है ।
- Ca(OH)₂ + Cl₂ → CaOCI₂ + H2O
विरंजक चूर्ण का उपयोग :-
- वस्त्र उद्योग में सूती व लिनेन के विरंजन के लिए ।
- कागज की फैक्टरी में लकड़ी के मज्जा के विरंजन के लिए ।
- रासायनिक उद्योगों में एक उपचायक के रूप में ।
- पीने वाले जल को जीवाणुओं से मुक्त करने के लिए रोगाणु नाशक के रूप में ।
3. बेकिंग सोडा :-
बेकिंग सोडा का उपयोग आमतौर पर रसोईघर में स्वादिष्ट खस्ता पकौड़े आदि बनाने के लिए किया जाता है । कभी – कभी इसका उपयोग खाने को शीघ्रता से पकाने के लिए भी किया जाता है ।
इस यौगिक का रासायनिक नाम सोडियम हाइड्रोजनकार्बोनेट ( NaHCO₃ ) है । इसको बनाने में सोडियम क्लोराइड का उपयोग एक मूल पदार्थ के रूप में किया जाता है ।
बेकिंग सोडा का उपयोग :-
- बेकिंग पाउडर बनाने में ( बेकिंग सोडा + टार्टरिक अम्ल ) का मिश्रण होता है ।
- इस अभिक्रिया से उत्पन्न CO₂ के कारण पावरोटी या केक में खमीर उठ जाता है तथा इस से यह मुलायम एवं स्पंजी हो जाता है ।
- यह ऐन्टैसिड का एक संघटक है ।
- इसका उपयोग सोडा – अम्ल अग्निशामक में भी किया जाता है ।
4. धोने का सोडा ( Na₂CO310H₂O ) :-
सोडियम कार्बोनेट के पुनः क्रिस्टलीकरण से धोने का सोडा प्राप्त होता है । यह एक क्षारकीय लवण है ।
- Na₂Co₃ + 10H₂0 → Na₂CO₃ 10H₂0
धोने के सोडा का उपयोग :-
- इसका उपयोग काँच , साबुन एवं कागज उद्योगों में होता है ।
- इसका उपयोग बोरेक्स के उत्पादन में होता है ।
- इसका उपयोग घरों में साफ – सफाई के लिए होता है ।
- जल की स्थायी कठोरता को हटाने के लिए इसका उपयोग होता है ।
5. प्लास्टर ऑफ पेरिस CaSO₄1/2H₂0 :-
जिप्सम को 373k पर गर्म करने पर यह जल के अणुओं को त्याग कर कैल्सियम सल्फेट हेमिहाइड्रेट ( POP ) बनाता है ।
यह सफेद चूर्ण है जो जल मिलाने पर यह पुनः जिप्सम बनकर ठोस प्रदान करता है ।
प्लास्टर ऑफ पेरिस का उपयोग :-
- प्लास्टर ऑफ पेरिस का उपयोग डॉक्टर टूटी हुई हड्डियों को सही जगह पर स्थिर रखने के लिए करते हैं ।
- इसका उपयोग खिलौने बनाने , सजावट का समान बनाने के लिए किया जाता है ।
- इसका उपयोग सतह को चिकना बनाने के लिए किया जाता है ।
क्रिस्टलन का जल :-
लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं ।
उदाहरण :-
- Cuso₄.5H₂0 में क्रिस्टलन के जल के 5 अणु हैं ।
- Na₂CO₃. 10H₂0 में क्रिस्टलन के जल के 10 अणु हैं ।
- Caso₄.2H₂O में क्रिस्टलन के जल के 2 अणु हैं ।